La sala es emocionante, pero más por lo que esconde que por lo que muestra. Realmente es tan solo un espacio muy blanco de paredes curvadas plagado de mesas móviles. Y, en cada una de ellas, unos bloques negros y blancos que recuerdan por su tamaño a ordenadores antiguos.
Falsas apariencias.
Los bloques son, en realidad, unos de los más modernos secuenciadores genéticos del momento: el motor del Centro Nacional de Análisis Genómico (CNAG), en Barcelona. Nos los muestra Holger Heyn, un alemán que lleva ya cerca de diez años investigando en España y que ahora es el responsable del equipo de Genómica de Célula Única en el propio CNAG.
Ese análisis célula a célula es la gran esperanza científica para desentrañar el desarrollo de los organismos —humanos incluidos—, para establecer las bases de la regeneración de órganos, para crear un mapa de todas nuestras células o para destapar claves de algunas enfermedades tan esquivas como el cáncer. De ahí que haya sido escogido como avance científico del año 2018 por la revista Science, y de ahí esta visita.
De batidos y árboles
“La genómica unicelular ha alcanzado la madurez de manera increíble”, decía hace un tiempo en una conferencia Eric Lander, el más que influyente director del Instituto Broad del MIT y Harvard. “Y, una vez que te das cuenta de que podemos hacer los análisis en células individuales, ¿cómo vas a aceptar un batido? Es una locura estar haciendo genómica en batidos”.
Visitamos el principal laboratorio dedicado al análisis célula a célula en España: el CNAG de Barcelona./ CNAG
Los ‘batidos’ de Lander son los análisis tradicionales donde se recogen un montón de células cuyo ADN (o ARN, el mensajero del ADN) se mezcla antes de pasar por los secuenciadores. La información que resulta es un promedio del conjunto. Habrá árboles particulares que queden ocultos por el bosque y, sobre todo, no permite saber qué información concreta contiene cada célula en particular. El individuo se disuelve en la masa.
El análisis célula a célula es la gran esperanza científica para destapar claves de enfermedades tan esquivas como el cáncer
Estos análisis ya habían sido escogidos como el Método del Año en 2013 por la revista Nature. “Pero por entonces apenas podían estudiarse diez o veinte células, eran tremendamente caros y muy poco resolutivos”, comenta Heyn. Ahora, en cambio, “podemos analizar 10.000 células en un solo experimento y hay proyectos para hacerlo con hasta un millón”.
La tecnología clave que ha posibilitado este salto es la basada en microfluidos, una herramienta que permite separar y canalizar cada célula en gotas diminutas a la vez que se introduce en su ADN un marcador o código de barras. Ese marcador permite identificar cada una de ellas una vez que han sido analizadas.
De esa manera puede estudiarse su ADN, su ARN e incluso su información epigenética, que pone los puntos y comas a la lectura del genoma. “La resolución no es perfecta todavía en ningún caso —reconoce Heyn—, pero lo más potente ahora mismo es el estudio del ARN”. En algunos de esos estudios se basó el reconocimiento al avance del año.
Un gusano que crece célula a célula
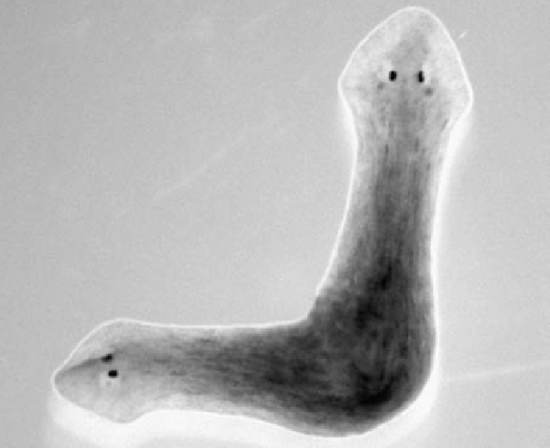
La planaria Schmidtea mediterranea es un animal insólito. Este gusano de apenas un centímetro es potencialmente inmortal: sus células madre renuevan sus órganos de manera continua y, si se parte en varios trozos, de cada uno emerge un nuevo gusano. La cabeza es capaz de regenerar una cola y la cola una cabeza, que incluso parece conservar algunos de sus recuerdos. Fue descubierto por el biólogo Jaume Baguñà en un pantano de Montjuic en 1968. Que se sepa, hoy apenas vive en Barcelona, en ciertas zonas de Menorca… y en una veintena de laboratorios de todo el mundo.
Foto de ‘Schmidtea mediterránea’ con dos cabezas en un experimento realizado durante la regeneración del tronco. / Dany S Adams
Uno de ellos está en el Centro de Medicina Molecular Max Delbrück, en Alemania. Allí, en 2018, usaron las técnicas de análisis célula a célula no solo para establecer un atlas celular del animal, sino también para estudiar los programas genéticos que conducían a su formación y regeneración. Entre otras sorpresas, encontraron que la cantidad de algunas células disminuía muy rápidamente. Eso indicaba que podían ser la reserva que alimentara el proceso de regeneración.
¿Podrían aplicarse esos descubrimientos a humanos para impulsar la medicina regenerativa? “Aún nos falta mucho por saber”, contestan en un correo consensuado Mireya Plass y Jordi Solana, los dos primeros firmantes del trabajo. “Las planarias adultas tienen más de un 30 % de células madre, cosa que dista mucho de nosotros. Aun así, esperamos que algunos de los mecanismos sí que sean los mismos”.
Lo que tienen claro es que antes no eran capaces de distinguir los distintos tipos de células en el desarrollo embrionario, y ahora van a recoger información “que será crucial para generar en el laboratorio células, tejidos y órganos que sirvan para tratar distintas patologías”.
Experimentos con el anfibio de Cortázar
Hubo un tiempo en que el escritor Julio Cortázar “pensaba mucho en los axolotl”. Tanto como para dedicarles un cuento asombroso a estos anfibios hipnóticos que se confunden con salamandras y que, como ellas, son capaces de regenerar sus miembros, esqueleto incluido. Cortázar estaba obsesionado con su mirada, ¿pero cómo consiguen ese inmenso poder de renovación?
Usando el nuevo arsenal de técnicas, investigadores alemanes han comprobado cómo un tipo particular de células se desprograma para volver a un estado similar al embrionario y, a partir de ahí, dirigir la regeneración en los axolotl. Nuestra limitadísima habilidad para conseguir algo parecido quizá se deba a la incapacidad para reprogramar este tipo de células hasta esos estados. Nuestro hígado o nuestra piel pueden regenerarse parcialmente, pero son excepciones. No podemos hacer lo mismo con una pierna, un riñón o un corazón.
Gracias a estas técnicas se ha podido ver cómo actúan las células de los axolotl para regenerar sus miembros
Aquí el análisis crucial es el del ARN. El ADN no aporta información valiosa: esencialmente es el mismo en cada célula, lo importante es cómo se lee el código en forma de ARN en cada momento y lugar. Eso es lo que permite estudiar cómo, a partir de una única célula, se forma un animal con todos sus órganos y tejidos, tan diferentes entre sí pero tan iguales en su genética inicial. Cómo somos lo que somos.
Así lo han hecho otros grupos de investigación en 2018 con peces y ranas, viendo cómo se encienden y apagan los genes en cada célula durante su desarrollo. Y así han conseguido seguir el desarrollo del cerebro y la médula espinal de un ratón hasta el día once tras su nacimiento, identificando en el camino más de cien tipos de células diferentes.
“Son estudios muy bonitos”, reconoce Heyn. “Permiten ver cosas que antes no podíamos ver y seguir el crecimiento sin hipótesis previas: cómo una célula se divide y empieza a hacer cosas diferentes en cada división”. Sin embargo, “esa es solo una pequeña parte de las posibilidades que ofrece”. Heyn se refiere a la posibilidad de trazar todo un atlas humano y a sus posibles aplicaciones en la medicina.
Axolotl, el anfibio que intrigaba a Cortázar y que es capaz de autorregenerarse. / Research Institute of Molecular Pathology
Un atlas celular que es una tabla periódica
Eric Lander lo explica así: “Si tuviéramos una tabla periódica de las células seríamos capaces de averiguar la composición de cualquier muestra”. Esa teórica tabla periódica que en su día revolucionó la química ha adoptado otra imagen, la de un atlas celular, y ha dado lugar a un proyecto que recoge la idea: el “Human Cell Atlas” (el Atlas Celular Humano).
Su objetivo es identificar cada célula del cuerpo, dónde se localiza y cómo actúa junto con el resto para formar los órganos y tejidos. Algo así como un Google Maps celular que sirva de referencia para “que luego podamos colocar las casas y los edificios encima”, visualiza Heyn, quien no duda de que será algo que “cambiará las reglas del juego, como en su día lo hizo el Proyecto Genoma”. La próxima reunión de la iniciativa tendrá lugar en octubre, en Barcelona.
Aunque es un consorcio voluntario y sin una financiación específica, ha contado con mecenas tan populares como Mark Zuckerberg, el fundador de Facebook, que “impulsó su inicio y colabora cofinanciando estudios concretos”.
Según los expertos, el Atlas Celular Humano cambiará las reglas del juego, como en su día lo hizo el Proyecto Genoma
El grupo de Heyn participa de dos maneras: es el responsable del control de calidad del proyecto y está encargado de estudiar todos los tipos de linfocitos B —las células que fabrican los anticuerpos— que existen en el cuerpo humano. “Queremos ver cómo se desarrollan y activan en cada lugar, cómo funcionan y cómo cambian mientras viajan por el cuerpo”.
Antes se pensaba que había 500 tipos de células diferentes, ahora se dice que hay al menos diez veces más. “Pero los números bailan mucho y seguramente sean aún mayores”, reconoce Heyn. “La clave está en pensar que las células son increíblemente plásticas, que hay muchísima más variedad de la que hasta hace nada podíamos estudiar”.
En apenas dos años de vida, el proyecto ya ha producido avances: ha servido para identificar un nuevo tipo de neuronas, a las que han llamado ‘rosa mosqueta’ y que por el momento parecen exclusivas de los humanos; ha permitido establecer un mapa de las células de la barrera placentaria y descubrir aquellas que modulan la respuesta de las defensas e impiden su rechazo; han hallado, incluso, un nuevo tipo de célula pulmonar que parece involucrada en la fibrosis quística, una enfermedad hereditaria potencialmente mortal.
Una vez delimitada la función de una célula, cuando esa función falle en el organismo sabremos quién es la responsable, qué célula hay que estudiar. El proyecto LifeTime propone enfocar este tipo de técnicas al estudio de la enfermedad. La iniciativa aspira a conseguir —y ha llegado a la fase final de evaluación— una financiación de 1.000 millones de euros de la Comisión Europea como proyecto Flagship (igual que lo fueron el Proyecto Grafeno o el del Cerebro Humano).
Una de las enfermedades donde más darán que hablar las nuevas herramientas es el cáncer. Si estas técnicas tienen sentido “allí donde haya heterogeneidad”, como subraya Heyn, el cáncer es el perfecto candidato.
El alemán Holger Heyn es el responsable del equipo de Genómica de Célula Única en el CNAG. / CNAG
En la salud y en la enfermedad
Un tumor es, en esencia, una máquina evolutiva. Acumula cambios y mutaciones de forma desenfrenada. Pero los cambios pueden ser diferentes en unas células u otras. Algunas pueden dar lugar a metástasis, otras son capaces de resistir a los tratamientos y regenerar el tumor y las de más allá se limitan a crecer sin aparente control. Si las células sanas comparten en esencia un mismo ADN, las de un tumor pueden ser primas muy lejanas.
La heterogeneidad y la capacidad evolutiva del cáncer son uno de los grandes retos de la medicina y, seguramente, el gran obstáculo de la nueva medicina de precisión. El que algunas células adquieran nuevas mutaciones clave —o que unas pocas sean capaces de resistir el tratamiento escogido— hace que la eficacia de las terapias sea, generalmente, solo temporal. Las técnicas de análisis célula a célula pueden servir para conocer mejor la biología del cáncer y, con ello, superar parte de estos obstáculos.
El análisis ya ha dado lugar a un posible tratamiento para prevenir el retinoblastoma, un cáncer hereditario
“Antes teníamos que deducir esa evolución, ahora puedes ver directamente el árbol que construye”, explica Heyn. Las aplicaciones —aunque incipientes y no exentas de dificultades— son notables. Por ejemplo: los grandes proyectos de medicina de precisión se están basando en dar tratamientos si encuentran una determinada mutación en el tumor, pero no tienen en cuenta la cantidad de células que la contienen y, sobre todo, no pueden saber qué tipo de células son y cuál es su función. Así no solo es más difícil predecir su eficacia, también lo es evitar las recaídas de la enfermedad.
Otro ejemplo: no se conoce el tipo de células que dan origen a muchos tumores. En el caso del retinoblastoma, un cáncer hereditario, este análisis ha permitido identificar la pequeña población de células de la retina que lo inicia. Al aislarlas y estudiar su metabolismo, los investigadores han propuesto un tratamiento para prevenirlo. “Como los efectos se producen solo en estas células, no podíamos verlos cuando analizábamos el tejido completo del ojo”, explican.
Por qué somos como somos
Los potentes programas informáticos de estos análisis contribuirán también al desarrollo de la biopsia líquida, la posibilidad de detectar o seguir la evolución de un tumor a través de su rastro en la sangre. Y la tecnología ya se está empleando para estudiar con detalle la respuesta de nuestras defensas y qué tipo concreto de células actúan en la tan prometedora inmunoterapia contra el cáncer. Conocerlas es un paso clave para conseguir mejorarla.
“Podemos ver aquello que ni siquiera sabíamos que existía”, afirma Heyn
“Otras enfermedades que pueden beneficiarse de estas técnicas son las autoinmunes —afirma Heyn— porque todavía no sabemos qué tipo de células son las que producen los ataques”. Entre ellas están enfermedades inflamatorias como la de Crohn, el lupus o la esclerosis múltiple. “Y también servirá para saber en el alzhéimer qué tipo de células mueren en cada etapa”.
La visita termina con una declaración entusiasta en la que, sin embargo, es difícil encontrar impostación: “Estas técnicas nos permiten ver aquello que ni siquiera sabíamos que existía”, afirma Heyn. “Nos van a ayudar a estudiar la complejidad de la vida, a saber cómo estamos construidos. Y, una vez tengamos un atlas, podremos compararlo con aquello que falla, en nosotros y entre nosotros”.
¿Eran o no eran emocionantes los bloques de la sala inicial?