Tectónica de Placas 1º, 4º y 1º bachiller
Mes: julio 2019
Frutos 1º eso
El agua, recurso indispensable para la vida 1ºESO
El agua, recurso indispensable para la vida Ambientech
1º Bachiller Los árboles
1º ESO Artrópodos
Diversidad sexual 3º ESO
Vídeo de diversidad sexual
¿Es la anorexia nerviosa una enfermedad del metabolismo?
Un análisis genético, de miles de pacientes, sugiere que el origen de este trastorno de la alimentación no reside solo en la mente.
También te puede interesar
La anorexia nerviosa afecta entre el 1 y el 4 por ciento de la población mundial femenina, así como el 0,3 por ciento de la masculina. Hasta la fecha, esta compleja enfermedad se define como un trastorno psiquiátrico. Sin embargo, un estudio genético reciente, publicado por la revista Nature Genetics, sugiere que el metabolismo también desempeña un importante papel en el desarrollo de la enfermedad.
Hunna J. Watson de la Universidad de Carolina del Norte en Chapel Hill, junto con más de 100 científicos de centros de investigación europeos, norteamericanos, australianos y asiáticos, realizó un estudio de asociación del genoma completo (GWAS, por sus siglas en inglés) e identificó 8 variantes genéticas relacionadas con la anorexia nerviosa.
El análisis GWAS comparó 16.992 casos de anorexia nerviosa con 55.525 sujetos sanos, de descendencia europea y 17 nacionalidades distintas. Este tipo de confrontación de datos procedentes de un elevado número de individuos permite hallar genes presuntamente asociados con características observables, como por ejemplo enfermedades.
De acuerdo con los resultados, las alteraciones genéticas identificadas en la investigación también participan en otros desórdenes de conducta, como la depresión, la ansiedad, la esquizofrenia y el trastorno obsesivo compulsivo. Ello explicaría por qué algunos pacientes manifiestan la anorexia nerviosa junto con estas enfermedades psiquiátricas.
No obstante, la novedad del trabajo reside en otra coincidencia. Al parecer, la anorexia nerviosa compartiría características genéticas con la diabetes de tipo 2 o el metabolismo de las grasas. Asimismo, las regiones del genoma alteradas también influenciarían la actividad física. De hecho, la hiperactividad patológica constituye una de las manifestaciones clínicas de este trastorno de alimentación.
Hasta la fecha, cualquier cambio observado en el metabolismo de los pacientes se atribuía a la inanición ocasionada por la poca o nula ingesta de comida. Ahora, sin embargo, los autores postulan que las alteraciones metabólicas podrían constituir el origen, no la consecuencia, de la anorexia nerviosa. Asimismo, para los investigadores, la desregulación del metabolismo dificultaría a los pacientes recuperar el peso perdido, incluso después de someterse a tratamiento médico.
De confirmarse, el hallazgo no solo ofrecería nuevas vías para luchar contra la enfermedad, si no que también supondría una nueva definición de la anorexia nerviosa como un trastorno metabólico, además de psiquiátrico.
Marta Pulido Salgado
Referencia: «Genome-wide association study identifies eight risk loci and implicates metabo-psychiatric origins for anorexia nervosa», de H. J. Watson et al., en Nature Genetics, publicado el 15 de julio de 2019.
Leer en Investigación y ciencia
Preparados para ver cómo cambia la vida célula a célula
El análisis de célula única permitirá entender el asombroso poder de regeneración de las salamandras, cartografiar todas nuestras células en un ‘Google Maps’ biológico y combatir el cáncer o las patologías autoinmunes. Por algo fue el Método del Año para la revista ‘Nature’ en 2013 y el gran avance científico de 2018 en ‘Science’.
La sala es emocionante, pero más por lo que esconde que por lo que muestra. Realmente es tan solo un espacio muy blanco de paredes curvadas plagado de mesas móviles. Y, en cada una de ellas, unos bloques negros y blancos que recuerdan por su tamaño a ordenadores antiguos.
Falsas apariencias.
Los bloques son, en realidad, unos de los más modernos secuenciadores genéticos del momento: el motor del Centro Nacional de Análisis Genómico (CNAG), en Barcelona. Nos los muestra Holger Heyn, un alemán que lleva ya cerca de diez años investigando en España y que ahora es el responsable del equipo de Genómica de Célula Única en el propio CNAG.
Ese análisis célula a célula es la gran esperanza científica para desentrañar el desarrollo de los organismos —humanos incluidos—, para establecer las bases de la regeneración de órganos, para crear un mapa de todas nuestras células o para destapar claves de algunas enfermedades tan esquivas como el cáncer. De ahí que haya sido escogido como avance científico del año 2018 por la revista Science, y de ahí esta visita.
De batidos y árboles
“La genómica unicelular ha alcanzado la madurez de manera increíble”, decía hace un tiempo en una conferencia Eric Lander, el más que influyente director del Instituto Broad del MIT y Harvard. “Y, una vez que te das cuenta de que podemos hacer los análisis en células individuales, ¿cómo vas a aceptar un batido? Es una locura estar haciendo genómica en batidos”.
Los ‘batidos’ de Lander son los análisis tradicionales donde se recogen un montón de células cuyo ADN (o ARN, el mensajero del ADN) se mezcla antes de pasar por los secuenciadores. La información que resulta es un promedio del conjunto. Habrá árboles particulares que queden ocultos por el bosque y, sobre todo, no permite saber qué información concreta contiene cada célula en particular. El individuo se disuelve en la masa.
El análisis célula a célula es la gran esperanza científica para destapar claves de enfermedades tan esquivas como el cáncer
Estos análisis ya habían sido escogidos como el Método del Año en 2013 por la revista Nature. “Pero por entonces apenas podían estudiarse diez o veinte células, eran tremendamente caros y muy poco resolutivos”, comenta Heyn. Ahora, en cambio, “podemos analizar 10.000 células en un solo experimento y hay proyectos para hacerlo con hasta un millón”.
La tecnología clave que ha posibilitado este salto es la basada en microfluidos, una herramienta que permite separar y canalizar cada célula en gotas diminutas a la vez que se introduce en su ADN un marcador o código de barras. Ese marcador permite identificar cada una de ellas una vez que han sido analizadas.
De esa manera puede estudiarse su ADN, su ARN e incluso su información epigenética, que pone los puntos y comas a la lectura del genoma. “La resolución no es perfecta todavía en ningún caso —reconoce Heyn—, pero lo más potente ahora mismo es el estudio del ARN”. En algunos de esos estudios se basó el reconocimiento al avance del año.
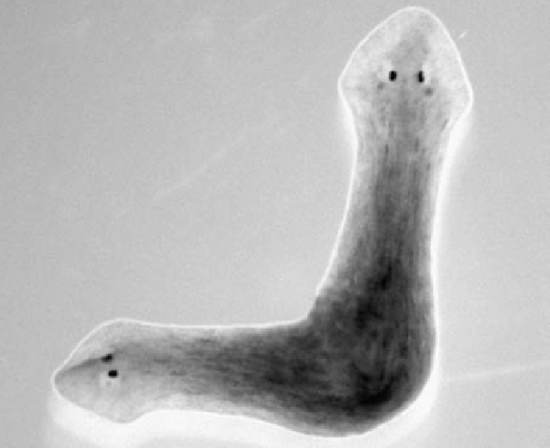
Un gusano que crece célula a célula
La planaria Schmidtea mediterranea es un animal insólito. Este gusano de apenas un centímetro es potencialmente inmortal: sus células madre renuevan sus órganos de manera continua y, si se parte en varios trozos, de cada uno emerge un nuevo gusano. La cabeza es capaz de regenerar una cola y la cola una cabeza, que incluso parece conservar algunos de sus recuerdos. Fue descubierto por el biólogo Jaume Baguñà en un pantano de Montjuic en 1968. Que se sepa, hoy apenas vive en Barcelona, en ciertas zonas de Menorca… y en una veintena de laboratorios de todo el mundo.
Uno de ellos está en el Centro de Medicina Molecular Max Delbrück, en Alemania. Allí, en 2018, usaron las técnicas de análisis célula a célula no solo para establecer un atlas celular del animal, sino también para estudiar los programas genéticos que conducían a su formación y regeneración. Entre otras sorpresas, encontraron que la cantidad de algunas células disminuía muy rápidamente. Eso indicaba que podían ser la reserva que alimentara el proceso de regeneración.
¿Podrían aplicarse esos descubrimientos a humanos para impulsar la medicina regenerativa? “Aún nos falta mucho por saber”, contestan en un correo consensuado Mireya Plass y Jordi Solana, los dos primeros firmantes del trabajo. “Las planarias adultas tienen más de un 30 % de células madre, cosa que dista mucho de nosotros. Aun así, esperamos que algunos de los mecanismos sí que sean los mismos”.
Lo que tienen claro es que antes no eran capaces de distinguir los distintos tipos de células en el desarrollo embrionario, y ahora van a recoger información “que será crucial para generar en el laboratorio células, tejidos y órganos que sirvan para tratar distintas patologías”.
Experimentos con el anfibio de Cortázar
Hubo un tiempo en que el escritor Julio Cortázar “pensaba mucho en los axolotl”. Tanto como para dedicarles un cuento asombroso a estos anfibios hipnóticos que se confunden con salamandras y que, como ellas, son capaces de regenerar sus miembros, esqueleto incluido. Cortázar estaba obsesionado con su mirada, ¿pero cómo consiguen ese inmenso poder de renovación?
Usando el nuevo arsenal de técnicas, investigadores alemanes han comprobado cómo un tipo particular de células se desprograma para volver a un estado similar al embrionario y, a partir de ahí, dirigir la regeneración en los axolotl. Nuestra limitadísima habilidad para conseguir algo parecido quizá se deba a la incapacidad para reprogramar este tipo de células hasta esos estados. Nuestro hígado o nuestra piel pueden regenerarse parcialmente, pero son excepciones. No podemos hacer lo mismo con una pierna, un riñón o un corazón.
Gracias a estas técnicas se ha podido ver cómo actúan las células de los axolotl para regenerar sus miembros
Aquí el análisis crucial es el del ARN. El ADN no aporta información valiosa: esencialmente es el mismo en cada célula, lo importante es cómo se lee el código en forma de ARN en cada momento y lugar. Eso es lo que permite estudiar cómo, a partir de una única célula, se forma un animal con todos sus órganos y tejidos, tan diferentes entre sí pero tan iguales en su genética inicial. Cómo somos lo que somos.
Así lo han hecho otros grupos de investigación en 2018 con peces y ranas, viendo cómo se encienden y apagan los genes en cada célula durante su desarrollo. Y así han conseguido seguir el desarrollo del cerebro y la médula espinal de un ratón hasta el día once tras su nacimiento, identificando en el camino más de cien tipos de células diferentes.
“Son estudios muy bonitos”, reconoce Heyn. “Permiten ver cosas que antes no podíamos ver y seguir el crecimiento sin hipótesis previas: cómo una célula se divide y empieza a hacer cosas diferentes en cada división”. Sin embargo, “esa es solo una pequeña parte de las posibilidades que ofrece”. Heyn se refiere a la posibilidad de trazar todo un atlas humano y a sus posibles aplicaciones en la medicina.
Un atlas celular que es una tabla periódica
Eric Lander lo explica así: “Si tuviéramos una tabla periódica de las células seríamos capaces de averiguar la composición de cualquier muestra”. Esa teórica tabla periódica que en su día revolucionó la química ha adoptado otra imagen, la de un atlas celular, y ha dado lugar a un proyecto que recoge la idea: el “Human Cell Atlas” (el Atlas Celular Humano).
Su objetivo es identificar cada célula del cuerpo, dónde se localiza y cómo actúa junto con el resto para formar los órganos y tejidos. Algo así como un Google Maps celular que sirva de referencia para “que luego podamos colocar las casas y los edificios encima”, visualiza Heyn, quien no duda de que será algo que “cambiará las reglas del juego, como en su día lo hizo el Proyecto Genoma”. La próxima reunión de la iniciativa tendrá lugar en octubre, en Barcelona.
Aunque es un consorcio voluntario y sin una financiación específica, ha contado con mecenas tan populares como Mark Zuckerberg, el fundador de Facebook, que “impulsó su inicio y colabora cofinanciando estudios concretos”.
Según los expertos, el Atlas Celular Humano cambiará las reglas del juego, como en su día lo hizo el Proyecto Genoma
El grupo de Heyn participa de dos maneras: es el responsable del control de calidad del proyecto y está encargado de estudiar todos los tipos de linfocitos B —las células que fabrican los anticuerpos— que existen en el cuerpo humano. “Queremos ver cómo se desarrollan y activan en cada lugar, cómo funcionan y cómo cambian mientras viajan por el cuerpo”.
Antes se pensaba que había 500 tipos de células diferentes, ahora se dice que hay al menos diez veces más. “Pero los números bailan mucho y seguramente sean aún mayores”, reconoce Heyn. “La clave está en pensar que las células son increíblemente plásticas, que hay muchísima más variedad de la que hasta hace nada podíamos estudiar”.
En apenas dos años de vida, el proyecto ya ha producido avances: ha servido para identificar un nuevo tipo de neuronas, a las que han llamado ‘rosa mosqueta’ y que por el momento parecen exclusivas de los humanos; ha permitido establecer un mapa de las células de la barrera placentaria y descubrir aquellas que modulan la respuesta de las defensas e impiden su rechazo; han hallado, incluso, un nuevo tipo de célula pulmonar que parece involucrada en la fibrosis quística, una enfermedad hereditaria potencialmente mortal.
Una vez delimitada la función de una célula, cuando esa función falle en el organismo sabremos quién es la responsable, qué célula hay que estudiar. El proyecto LifeTime propone enfocar este tipo de técnicas al estudio de la enfermedad. La iniciativa aspira a conseguir —y ha llegado a la fase final de evaluación— una financiación de 1.000 millones de euros de la Comisión Europea como proyecto Flagship (igual que lo fueron el Proyecto Grafeno o el del Cerebro Humano).
Una de las enfermedades donde más darán que hablar las nuevas herramientas es el cáncer. Si estas técnicas tienen sentido “allí donde haya heterogeneidad”, como subraya Heyn, el cáncer es el perfecto candidato.
En la salud y en la enfermedad
Un tumor es, en esencia, una máquina evolutiva. Acumula cambios y mutaciones de forma desenfrenada. Pero los cambios pueden ser diferentes en unas células u otras. Algunas pueden dar lugar a metástasis, otras son capaces de resistir a los tratamientos y regenerar el tumor y las de más allá se limitan a crecer sin aparente control. Si las células sanas comparten en esencia un mismo ADN, las de un tumor pueden ser primas muy lejanas.
La heterogeneidad y la capacidad evolutiva del cáncer son uno de los grandes retos de la medicina y, seguramente, el gran obstáculo de la nueva medicina de precisión. El que algunas células adquieran nuevas mutaciones clave —o que unas pocas sean capaces de resistir el tratamiento escogido— hace que la eficacia de las terapias sea, generalmente, solo temporal. Las técnicas de análisis célula a célula pueden servir para conocer mejor la biología del cáncer y, con ello, superar parte de estos obstáculos.
El análisis ya ha dado lugar a un posible tratamiento para prevenir el retinoblastoma, un cáncer hereditario
“Antes teníamos que deducir esa evolución, ahora puedes ver directamente el árbol que construye”, explica Heyn. Las aplicaciones —aunque incipientes y no exentas de dificultades— son notables. Por ejemplo: los grandes proyectos de medicina de precisión se están basando en dar tratamientos si encuentran una determinada mutación en el tumor, pero no tienen en cuenta la cantidad de células que la contienen y, sobre todo, no pueden saber qué tipo de células son y cuál es su función. Así no solo es más difícil predecir su eficacia, también lo es evitar las recaídas de la enfermedad.
Otro ejemplo: no se conoce el tipo de células que dan origen a muchos tumores. En el caso del retinoblastoma, un cáncer hereditario, este análisis ha permitido identificar la pequeña población de células de la retina que lo inicia. Al aislarlas y estudiar su metabolismo, los investigadores han propuesto un tratamiento para prevenirlo. “Como los efectos se producen solo en estas células, no podíamos verlos cuando analizábamos el tejido completo del ojo”, explican.
Por qué somos como somos
Los potentes programas informáticos de estos análisis contribuirán también al desarrollo de la biopsia líquida, la posibilidad de detectar o seguir la evolución de un tumor a través de su rastro en la sangre. Y la tecnología ya se está empleando para estudiar con detalle la respuesta de nuestras defensas y qué tipo concreto de células actúan en la tan prometedora inmunoterapia contra el cáncer. Conocerlas es un paso clave para conseguir mejorarla.
“Podemos ver aquello que ni siquiera sabíamos que existía”, afirma Heyn
“Otras enfermedades que pueden beneficiarse de estas técnicas son las autoinmunes —afirma Heyn— porque todavía no sabemos qué tipo de células son las que producen los ataques”. Entre ellas están enfermedades inflamatorias como la de Crohn, el lupus o la esclerosis múltiple. “Y también servirá para saber en el alzhéimer qué tipo de células mueren en cada etapa”.
La visita termina con una declaración entusiasta en la que, sin embargo, es difícil encontrar impostación: “Estas técnicas nos permiten ver aquello que ni siquiera sabíamos que existía”, afirma Heyn. “Nos van a ayudar a estudiar la complejidad de la vida, a saber cómo estamos construidos. Y, una vez tengamos un atlas, podremos compararlo con aquello que falla, en nosotros y entre nosotros”.
¿Eran o no eran emocionantes los bloques de la sala inicial?
Jesús Méndez

Escritor, periodista científico, exinvestigador de la epigenética del cáncer y médico de formación. Colabora con Sinc escribiendo sobre lo que sabe (más o menos).
leer en agencia sinc
Aditivos que son beneficiosos para la salud
Los aditivos en la comida, esos que empiezan con la letra E, deberían ser la menor de nuestras preocupaciones
Estos son algunos de los aditivos que no solamente no son perjudiciales, sino que te benefician

Es posible que conozcas a alguna persona que mira con ansiedad las etiquetas de ingredientes de la comida buscando letras y números, como por ejemplo E330. Estos códigos tienen mala fama últimamente, la industria alimentaria lo sabe y a la mínima ocasión pone en el envase «sin aditivos».
Otra posible solución es que pongan ácido cítrico en lugar de E330, ya que parece que suena menos amenazador, pero seguirá siendo zumo de limón.

La seguridad alimentaria nunca es total, pero al contrario que el postre de tu menú del día que te venden como «casero», todos los aditivos han pasado una serie exhaustiva de pruebas para asegurarse de que no producen efectos adversos.
Por supuesto siempre hay un porcentaje pequeño de personas que tienen alergia a algún aditivo, igual que algunas personas son alérgicas a los cacahuetes o a la soja.
Los expertos coinciden en que los alimentos frescos y mínimamente procesados son mejores para la salud. Aun así, los aditivos son en general neutros y algunos de ellos aportan beneficios para la salud. La mayor parte de ellos se emplean como antioxidantes y conservadores.
Así que, si puedes aparcar tu quimiofobia durante un rato, estos son algunos de los aditivos que te debería alegrar encontrar en tu comida:
E300
Vitamina C
No necesita presentación, pero quizá no sepas que se utiliza habitualmente como conservante en la comida procesada, protegiéndola de la oxidación, igual que a ti te protege del estrés oxidativo y las enfermedades asociadas, especialmente las neurodegenerativas. Lo más probable es que en la etiqueta de detrás aparezca como ácido ascórbico, y luego en grande en la parte delantera del paquete en la forma «¡CON MÁS VITAMINA C!»
E101
Riboflavina o vitamina B2
Se usa como colorante amarillo, pero es una vitamina necesaria para regular la función tiroidea y la producción de sebo en la piel, por lo que es buena para el acné y el pelo graso, y se está estudiando como tratamiento del melanoma.
E100
Curcumina
Es el colorante amarillo que se usa en el curry y tiene propiedades antiinflamatorias y antioxidantes, especialmente si se combina con piperina, el principio activo de la pimienta negra.
E163
Antocianinas
Se extraen de la piel de las uvas negras para usarlas como colorante de color violeta, pero resulta que esta sustancia también es un poderoso antiinflamatorio y antioxidante que se está estudiando como prevención y tratamiento del cáncer.
E160d
Licopeno
Es un colorante rojo que se extrae del tomate y que, como los demás, es un antioxidante que protege al corazón, pero sobre todo a la piel y a los ojos de los rayos ultravioleta.
E412
Goma Guar
Es un espesante presente en helados, salsas y sopas. Contiene mucha fibra y provoca sensación de saciedad y en pacientes con diabetes y obesidad se ha comprobado que regula la glucosa y el colesterol.
E415
Goma Xantana
Otro espesante muy usado, tanto en la comida preparada como en tu restaurante, aunque no lo sepas. Se obtiene por fermentación de azúcares simples y, al igual que el anterior, ayuda a regular la glucosa y el colesterol.
E621
Glutamato Monosódico
Todavía sigue siendo sospechoso en la cabeza de la gente, pero sin motivo. Hace años que quedó totalmente aceptado por la EFSA y, muy lejos de ser perjudicial o dar dolor de cabeza (desmentido), es el responsable del sabor ‘umami’ y está presente de forma natural en muchos alimentos, desde el tomate hasta el queso. Este es un resumen de sus beneficios.
Inulina
Es un tipo de fibra que se extrae de la raíz de achicoria y está en helados y yogures para darles una textura más suave. Es un prebiótico que nutre a las bacterias intestinales y puede proteger contra la obesidad y la diabetes.
El principal problema de la comida procesada no son los aditivos, sino las enormes cantidades de azúcares y grasas refinadas que contienen y su bajo contenido en nutrientes. Dicho esto, come más verdura y comida sin procesar siempre que sea posible.
¿En qué se basa todo esto?
Preventive and therapeutic potential of ascorbic acid in neurodegenerative diseases. El ácido ascórbico actúa principalmente disminuyendo el estrés oxidativo y reduciendo la formación de agregados de proteínas, lo que puede contribuir a la reducción de las alteraciones cognitivas y/o motoras observadas en los procesos neurodegenerativos.
Irradiated Riboflavin Diminishes the Aggressiveness of Melanoma In Vitro and In Vivo. En conjunto, los datos actuales proporcionan evidencia de que los fotoproductos de riboflavina pueden proporcionar posibles candidatos para mejorar la eficacia del tratamiento del melanoma.
Curcumin: A Review of Its Effects on Human Health. Además, una dosis relativamente baja del complejo puede brindar beneficios de salud a las personas que no tienen enfermedades de salud diagnosticadas. La mayoría de estos beneficios pueden atribuirse a sus efectos antioxidantes y antiinflamatorios.
Ver en el Diario
Las 5 preguntas más importantes sobre CRISPR/Cas9
La novedosa técnica está revolucionando la ingeniería genética. Pero ¿resultan las tijeras moleculares CRISPR/Cas9 tan ventajosas como prometen?

La técnica de edición genética CRISPR/Cas9 funciona como unas tijeras selectivas que cortan y modifican cualquier secuencia del genoma con una gran precisión y eficacia. Pero ¿resultan siempre fiables? [iStock/vchal]
La ingeniería genética está experimentando un impulso renovador. Una década después del Proyecto del Genoma Humano, que no rindió todos los frutos esperados, ha irrumpido una técnica cuyas posibilidades parecen infinitas. CRISPR/Cas9, unas tijeras moleculares que modifican el ADN en puntos escogidos con una precisión sin precedentes, está generando nuevas esperanzas. La estrategia ya está revolucionando todas las áreas de la ingeniería genética, y se considera indiscutible que sus descubridores serán merecedores de un premio Nobel. No obstante, el método no se halla exento de problemas. Los efectos no deseados que puede provocar, las limitaciones técnicas y las objeciones éticas representan importantes obstáculos de la edición genética.
¿Cómo funciona CRISPR/Cas9?
La técnica de edición genética CRISPR/Cas9 se basa en un complejo sistema inmunitario de las bacterias que les protege contra los virus. Se trata de una inmunidad adquirida, o adaptativa, que «recuerda» las secuencias de ADN de los patógenos de ataques anteriores y corta su ADN en caso de una nueva infección.
También te puede interesar
Es precisamente esta combinación de reconocimiento y corte la que utiliza la técnica CRISPR/Cas9. En la variante más simple, se inyecta en la célula ARN que codifica una proteína llamada Cas9 y una secuencia de reconocimiento. La célula emplea el ARN para sintetizar la proteína, la cual se pone a trabajar junto con el ARN de reconocimiento añadido: Cas9 corta el ADN de doble cadena exactamente donde el fragmento de ARN asociado le indica que lo haga. Dado que es posible sintetizar artificialmente cualquier secuencia de ARN, tal combinación permite cortar cualquier genoma en cualquier lugar, al menos teóricamente.
Las llamadas secuencias CRISPR, presentes en el material genético de las bacterias, se conocen desde la década de 1980. El microbiólogo Francisco J. M. Mojica, de la Universidad de Alicante, contribuyó en una parte fundamental a su descubrimiento y denominación. La abreviatura significa «repeticiones palindrómicas cortas agrupadas y regularmente espaciadas», es decir, secuencias palindrómicas cortas repetidas que están separadas por otro material genético y que con frecuencia aparecen en el genoma en ubicaciones específicas. Resultó que el material genético que había entre las secuencias repetidas a menudo procedía de virus, lo que permitió deducir que CRISPR correspondía a un sistema que permitía a las bacterias defenderse de ellos.
Más tarde, se observó que todas las bacterias con dicho sistema presentaban, en la vecindad de CRISPR, unos genes asociados que se denominaron cas. Estos constituyen el elemento esencial de la defensa antivírica. El sistema CRISPR de la bacteria «cosecha» ADN vírico e integra partes de él entre las secuencias repetidas del genoma bacteriano. Como resultado, la célula produce ARN complementario del ADN vírico y lo ensambla con proteínas Cas. Si un virus intenta infectar de nuevo la célula con este ADN, el ARN «reconoce» el genoma del virus y, a continuación, las proteínas Cas lo cortan para que no vuelva a causar daños.
El origen de la técnica de edición genética se basa en el descubrimiento de que las proteínas Cas cortan cualquier ADN siempre que se les proporcione un ARN de reconocimiento adecuado, y esto es lo que hace CRISPR/Cas9. Después del corte, se confía en los mecanismos naturales de reparación de la célula, los cuales se ponen en marcha de forma espontánea.
Si en ese momento solo las dos partes del genoma se hallan separadas, interviene un mecanismo de reparación celular que las vuelve a conectar, aunque a menudo resulta impreciso y produce los llamados indeles, pequeños fragmentos de ADN que se insertan o eliminan en el punto de corte y que pueden inutilizar los genes implicados. Sin embargo, cuando el ADN flota libremente en la célula con los dos cabos sueltos, interviene otro sistema más precciso, denominado reparación por recombinación homóloga (HDR), que los vuelve a conectar y da lugar a cambios específicos en el genoma.
¿Cuáles son los problemas éticos?
Los expertos han estado debatiendo desde hace tiempo sobre los problemas éticos fundamentales asociados a la modificación genética en los seres humanos. Pero hasta ahora el debate había sido puramente hipotético, ya que los procedimientos eran demasiado burdos e imprecisos como para poderlos trasladar en serio en ensayos con humanos. Pero la edición genética permite en principio introducir cambios en el genoma con una elevada precisión. De hecho, ya en 2015, varios grupos de trabajo chinos informaron de que, mediante el método CRISPR/Cas9, habían intentado eliminar de embriones humanos ciertas enfermedades hereditarias. Reparar genes que provocan dolencias es actualmente la aplicación más obvia en los humanos, puesto que nadie puede objetar en contra de sus fines terapéuticos.
¿O en realidad sí? Los críticos temen que tales procedimientos hagan posponer aún más la definición de «defecto genético» hasta que todas las variantes genéticas, excepto las más necesarias, se consideren defectuosas y, por tanto, necesiten ser reparadas. El bebé de diseño, hecho a medida, el tema de muchas consideraciones más o menos útiles sobre la ética de las modificaciones en la línea germinal, aparecería así bajo el pretexto de la curación.
Sin embargo, el problema más urgente no son las posibles consecuencias de los bebés de diseño, sino, en primer lugar, las consecuencias que tales experimentos tendrán en vista del conocimiento extraordinariamente incompleto que se tiene de los efectos genéticos reales. Las investigaciones para crear un bebé «a medida» pueden conllevar décadas, pero no está claro si tal espera disuadirá a todo el mundo. Quizás tales experimentos simplemente se prohíban, como sucedió con unos experimentos de 2015 en los que se aumentaba la capacidad infecciosa de ciertos virus.
Por el contrario, la eliminación de enfermedades hereditarias ya se halla en la agenda. En algunos casos, la corrección de un solo un gen, o tal vez un solo alelo, probablemente será factible pronto. La mayoría de los expertos consideran que esta opción es éticamente justificable. Sin embargo, incluso en este caso existe el riesgo de que la intervención pueda tener consecuencias imprevisibles a largo plazo si, por ejemplo, el gen corregido se transmite a los descendientes y tiene en ellos efectos que nadie había previsto. En tiempo reciente, el sorprendente anuncio de un investigador chino de que había ayudado a nacer dos gemelas con el genoma editado para protegerlas del VIH despertó una enorme controversia.
En la actualidad, CRISPR/Cas9 y otros métodos relacionados ya están revolucionando todos los ámbitos en los que pueda tener interés la modificación genética. La edición genética resulta más fácil y más precisa que cualquier otra técnica diseñada hasta ahora. Pero, ante todo, debe quedar claro qué se entiende por un «organismo modificado genéticamente»: ¿lo es aquel con un gen modificado mediante CRISPR/Cas9 en un solo lugar? ¿O este simplemente ha incorporado una nueva variante a su acervo génico natural? ¿Es un cerdo sin sus retrovirus endógenos como cualquier otro cerdo?
Resultará interesante ver la reacción de los consumidores cuando tales organismos ocupen los estantes de los supermercados como productos que se hallan en el umbral entre lo «natural» y lo «artificial». En ese momento, a más tardar, la verdadera cuestión técnica de la definición de ingeniería genética se volverá emocional. Muchas personas no desean ver nada en su plato que esté «modificado genéticamente»; pero para ello será necesario reconocer los organismos modificados, incluso si sus genes cambiados no difieren de las variantes naturales y, por lo tanto, también pueden hibridarse con organismos inalterados. Tal transparencia difícilmente sería posible con el sistema actual, sobre todo por lo que se refiere el ganado.
![iStock-Bill-Oxford-700ample.jpg Análisis de ADN por electroforesis en gel. Las proteínas Cas pueden cortar cualquier ADN siempre y cuando se aporte también el ARN de reconocimiento apropiado. Después, uno debe confiar en los mecanismos naturales de reparación de la célula. [iStock/Bill Oxford]](https://www.investigacionyciencia.es/files/33557.jpg)
Las consideraciones éticas en torno a CRISPR/Cas9 abordan también/ el equilibrio entre los beneficios buscados y los riesgos de la técnica, como la posibilidad de modificar lugares no deseados del genoma. Los ecosistemas también pueden verse amenazados cuando se liberan en el medio silvestre mosquitos o productos agrícolas modificados genéticamente. Tampoco está claro cuál es el riesgo de que el material genético modificado salte a otras especies. Por otro lado, es difícil predecir las consecuencias de renunciar a la técnica cuando esta pretende curar una enfermedad. En ese caso, oponerse a la poderosa CRISPR/Cas9, a pesar de sus inconvenientes fundamentales, no resulta menos controvertida.
¿Cuáles son las limitaciones de CRISPR/Cas9?
En su origen biológico, CRISPR/Cas9 es un instrumento de destrucción: una rotura en una doble hebra representa una intervención bastante drástica del genoma y, a menudo, no puede repararse sin dejar un daño permanente. Esta propiedad puede resultar útil cuando se pretende incapacitar un gen mediante los denominados indeles: pares de bases que se eliminan o se añaden y hacen que la sección del genoma resulta ilegible. Desafortunadamente, a veces también se producen indeles cuando se incorpora ADN adicional a través del sistema de reparación HDR.
Si se necesita practicar una modificación genética de alta precisión, como en las terapias génicas, las roturas de doble cadena del sistema CRISPR original son, por lo tanto, un problema fundamental que uno desea evitar. Las nuevas variantes de CRISPR/Cas9, por ejemplo, cortan solo una hebra, lo que reduce notablemente los indeles en lugares no deseados del genoma y mejoran mucho la precisión de la técnica.
Aun así, nunca pueden evitarse del todo los cambios no deseados del sistema CRISPR/Cas9, los que se producen en lugares del genoma distintos del que se pretendía. Estos pueden tener lugar porque la enzima de corte Cas9 funciona incluso si el ARN de reconocimiento difiere de la secuencia de ADN en hasta cinco lugares. Tales errores son extaordinariamente difícíles de identificar después. O puede suceder el efecto contrario en genes que supuestamente han sido inactivados: si bien la mutación deseada se incorpora en el lugar adecuado del genoma, el gen sigue «leyéndose» correctamente.
La actual técnica de CRISPR/Cas9 también presenta otros problemas. Aunque puede cortar con precisión una ubicación definida del genoma, necesita que en la proximidad exista una secuencia de genes específica que no puede seleccionarse a voluntad. Este es el caso en la mayoría de los genomas, si bien no en todos (y, naturalmente, nunca en el que uno está trabajando). Además, la maquinaria CRISPR/Cas es muy voluminosa, por lo que resulta difícil introducirla en las primeras células embrionarias de los mamíferos: el gen cas y el ARN reconocimiento son simplemente demasiado grandes para los «transportadores» genéticos que se emplean habitualmente, los virus que introducen el material genético en la célula de interés. El ARN debe inyectarse directamente, lo que limita la eficacia.
De hecho, uno de los parámetros más importantes de una técnica de edición genética es su eficacia; dicho de otro modo, en qué proporción el genoma objetivo se modifica de la manera deseada. Ninguna de las tijeras genéticas utilizadas hoy en día garantizan que cumplan su misión; de hecho, la probabilidad de que lo hagan es relativamente baja, incluso en algunas de las aplicaciones más prometedoras. CRISPR/Cas9 no participa en realidad en la edición del gen de interés. Esta se produce de forma más o menos aleatoria. En las células madre humanas pluripotentes inducidas, por ejemplo, la eficacia de CRISPR/Cas9 es de entre el 2 y el 5 por ciento. En otros sistemas, como el de los embriones de pez cebra, la probabilidad de una mutación exitosa es a veces superior al 70 por ciento, aunque la terapia génica para las enfermedades hereditarias de los peces no constituyen un mercado muy grande.
¿Cuáles serán las aplicaciones futuras de CRISPR/Cas9?
En la investigación biotecnológica, CRISPR/Cas9 ha alcanzado una excelente posición como herramienta de ingeniería genética. Incluso se ha ido más allá con versiones nuevas que permiten regular de forma específica la actividad de los genes en el laboratorio. Para ello, se utiliza una proteína Cas9 inactivada, que se adhiere solo firmemente a fragmentos concretos de ADN. Si tal proteína se une a un dominio promotor, la actividad del gen correspondiente aumenta. Si, en cambio, bloquea la secuencia del gen en sí, el sector del genoma correspondiente deja de traducirse en ARN. Con la ayuda de diferentes proteínas unidas a sistemas Cas9 inactivos, ahora también es posible explorar los efectos epigenéticos, por ejemplo, marcando mediante fluorescencia la posición espacial de ciertas secuencias. Por medio de enzimas asociadas que escinden o unen grupos metilo o acilo, tales sistemas CRISPR/Cas9 también pueden alterar la epigenética de las células.
Pero, sobre todo, CRISPR/Cas9 se utiliza en la actualidad para crear de forma muy eficaz organismos modificados genéticamente, aquellos en los que un determinado gen se ha modificado, insertado o inactivado a través de una mutación. Tales procedimientos son mucho más antiguos que CRISPR. En 2007, por ejemplo, los inventores de la denominada inactivación (knockout) genética fueron galardonados con el premio Nobel de fisiología o medicina. No obstante, la técnica CRISPR/Cas9 es más rápida, más barata y más versátil que los métodos anteriores. En el laboratorio también puede solucionarse uno de los problemas principales de CRISPR: el tamaño requerido del ARN. En la actualidad, por ejemplo, existen varias razas de ratones que son portadoras de la proteína Cas9 en su propio genoma; tan pronto como llega a la célula una determinada señal molecular, como el ARN de reconocimiento correspondiente, la molécula se mantiene a la espera para alterar el genoma.
![iStock-Henrik5000-700ample.jpg Editar genes en embriones para evitar ciertas enfermedades graves sería la aplicación más obvia de CRISPR/Cas9 en los humanos. La principal objeción actual son los efectos no deseados que puede provocar la técnica debido a posibles errores en el corte y en los mecanismos de reparación celular posterior. [iStock/Henrik5000]](https://www.investigacionyciencia.es/files/33558.jpg)
También están en curso los primeros organismos modificados cuyo objetivo, más allá de la investigación básica, tiene aplicaciones prácticas. De esta manera, si los planes de los científicos tienen éxito, en el futuro se producirán mejores modelos animales para varias enfermedades humanas, y también se desarrollarán cultivos y animales con ciertas características, como mosquitos Anopheles resistentes a la malaria. Un ejemplo interesante es la eliminación, en del genoma del cerdo, de retrovirus potencialmente peligrosos, un requisito importante previo al plan de generar órganos humanos en animales.
Además, CRISPR/Cas9 ha hecho avanzar la técnica denominada impulso génico (gene drive), un mecanismo mediante el cual se hacen propagar con rapidez ciertos rasgos artificiales en poblaciones de animales silvestres. Ello resulta interesante para el control de mosquitos que transmiten enfermedades graves en algunas regiones. La investigación médica también ha puesto la atención en CRISPR/Cas9 como herramienta para luchar contra virus y bacterias patógenos, con el fin de realizar cortes precisos en el ADN de estos microorganismos e impedir que prosperen. Sin embargo, todavía no está del todo claro cómo transportar el ARN necesario a la ubicación deseada en una enfermedad real.
¿Qué alternativas existen a la técnica CRISPR/Cas9?
Una cosa es segura: a pesar de la sentencia en la disputa de patentes entre Emmanuelle Charpentier y Jennifer Doudna, por un lado, y Feng Zhang, por el otro, la batalla por los beneficios del método CRISPR/Cas9 no ha hecho más que empezar. Debido al enorme potencial de la técnica, las regalías se cuentan en miles de millones. Pero, si se mira en perspectiva, quizá no. Mientras que la Universidad de California todavía está en condiciones de obtener al menos de una parte del pastel, varios grupos de investigación han estado explorando otras opciones a la técnica.
Porque CRISPR/Cas9, como hemos visto, tiene desventajas y limitaciones. La más importante es que las tijeras genéticas solo son, en realidad, adecuadas para realizar un corte en el ADN. Si uno desea incorporar nuevo material genético, debe confiar en la célula. En muchos casos, la técnica no es lo suficientemente eficaz como para modificar varios genes a la vez, como se desea. Además, CRISPR/Cas9 no corta en todos los sitios del genoma.
Por esta razón, los métodos que precedieron a CRISPR/Cas9 no se han abandonado del todo: tanto las TALEN como las nucleasas con dedos de zinc, dos tipos de tijeras genéticas más antiguas, todavía se utilizan en la ingeniería genética. Estos procedimientos son mucho más complicados. Sin embargo, si además de los inconvenientes de CRISPR/Cas9 persiste durante más años la incertidumbre sobre los derechos de licencia, los expertos podrían alejarse de CRISPR/Cas9, al menos en lo que se refiere a la investigación con posibles aplicaciones comerciales.
También continúan las investigaciones sobre otras opciones. En la primavera de 2016, un grupo de investigación chino publicó un trabajo que indicaba que una proteína llamada NgAgo hacía lo mismo que CRISPR/Cas9, incluso mejor. Pero los resultados demostraron ser prematuros. Igual que sucedió con el entusiasmo que despertó una proteína llamada lambda Red, que se le supone la capacidad real de editar genes y que ha sido investigada por Zhang, el pionero de CRISPR, durante 14 años sin mucho éxito.
Lars Fischer